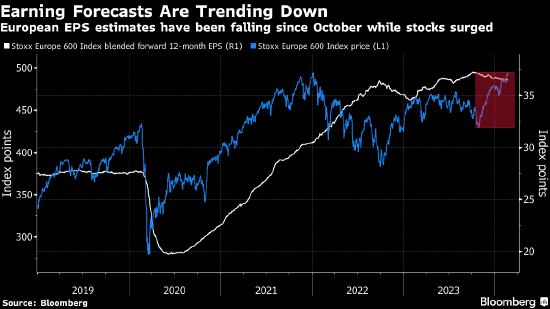
2月22日,再生元制药(REGN.US)宣布,美国FDA已接受其靶向B细胞成熟抗原(BCMA)与CD3的双特异性抗体疗法linvoseltamab的生物制品许可申请(BLA)并授予优先审评资格,用以治疗患有复发/难治性(R/R)多发性骨髓瘤(MM)的成年患者,患者在接受至少三种既往疗法后发生疾病进展。该申请的PDUFA日期为2024年8月22日。
据了解,Linvoseltamab是一种旨在将多发性骨髓瘤细胞上的BCMA与表达CD3的T细胞桥接,以促进T细胞活化和癌细胞杀伤的双特异性抗体。
这一申请的递交是基于关键性1/2期临床试验LINKER-MM1的结果。去年12月公布的试验结果显示,中位随访时间为11个月时,在1/2期临床试验(n=117)中接受剂量为200 mg的linvoseltamab治疗的患者中观察到客观缓解率为71%,46%达到完全缓解或更佳。

截至最新数据截止日期,所有接受200 mg治疗的患者均发生了不良事件(AE),其中85%的患者发生了≥3级不良***(AE)。最常发生的AE为细胞因子释放综合征(CRS;46%)。在CRS病例中,大多数(35%)为1级,10%为2级,1例(1%)为3级CRS。

(图片来源网络,侵删)

(图片来源网络,侵删)